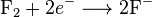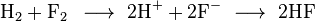Senin, 21 Januari 2013
Sabtu, 29 Desember 2012
Oksidator
 Oksidator adalah teknologi penguraian zat yang terlarut dalam air menjadi zat yang tidak larut dalam air sehingga mudah untuk dipisahkan dengan filtrasi untuk keperluan perbaikan kualitas pada pemberdayaan sumber air atau mengatasi masalah pada sumur dalam yang rata-rata tidak sesuai dengan PERMENKES suatu contoh pada kasus sumur simbang Boja:
Oksidator adalah teknologi penguraian zat yang terlarut dalam air menjadi zat yang tidak larut dalam air sehingga mudah untuk dipisahkan dengan filtrasi untuk keperluan perbaikan kualitas pada pemberdayaan sumber air atau mengatasi masalah pada sumur dalam yang rata-rata tidak sesuai dengan PERMENKES suatu contoh pada kasus sumur simbang Boja: 1.Kadar Fe air baku = 5,5 ppm
2.Debit = 10 ltr / dtk
3.Kondisi mati = 4 tahun
Senin, 17 Desember 2012
Redoks
Redoks (singkatan dari reaksi reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
Reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge) dikenal sebagai reaksi metatesis.
Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikatakan sebagai reduktif dan dikenal sebagai [[oksidator ]] atau agen reduksi. Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri teroksidasi. Oleh karena ia "mendonorkan" elektronnya, ia juga disebut sebagai penderma elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logam-logam ini akan memberikan elektronnya dengan mudah. Reduktor jenus lainnya adalah reagen transfer hidrida, misalnya NaBH4 dan LiAlH4), reagen-reagen ini digunakan dengan luas dalam kimia organik[1][2], terutama dalam reduksi senyawa-senyawa karbonil menjadi alkohol. Metode reduksi lainnya yang juga berguna melibatkan gas hidrogen (H2) dengan katalis paladium, platinum, atau nikel, Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbon-karbon.
Cara yang mudah untuk melihat proses redoks adalah, reduktor mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam sebuah reaksi disebut sebagai pasangan redoks.
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:
Oksidasi digunakan dalam berbagai industri seperti pada produksi produk-produk pembersih.
Reaksi redoks juga merupakan dasar dari sel elektrokimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
- Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge) dikenal sebagai reaksi metatesis.
Oksidator dan reduktor
Senyawa-senyawa yang memiliki kemampuan untuk mengoksidasi senyawa lain dikatakan sebagai oksidatif dan dikenal sebagai reduktor atau agen oksidasi. Oksidator melepaskan elektron dari senyawa lain, sehingga dirinya sendiri tereduksi. Oleh karena ia "menerima" elektron, ia juga disebut sebagai penerima elektron. Oksidator bisanya adalah senyawa-senyawa yang memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti H2O2, MnO4−, CrO3, Cr2O72−, OsO4) atau senyawa-senyawa yang sangat elektronegatif, sehingga dapat mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah senyawa (misalnya oksigen, fluorin, klorin, dan bromin).Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikatakan sebagai reduktif dan dikenal sebagai [[oksidator ]] atau agen reduksi. Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri teroksidasi. Oleh karena ia "mendonorkan" elektronnya, ia juga disebut sebagai penderma elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logam-logam ini akan memberikan elektronnya dengan mudah. Reduktor jenus lainnya adalah reagen transfer hidrida, misalnya NaBH4 dan LiAlH4), reagen-reagen ini digunakan dengan luas dalam kimia organik[1][2], terutama dalam reduksi senyawa-senyawa karbonil menjadi alkohol. Metode reduksi lainnya yang juga berguna melibatkan gas hidrogen (H2) dengan katalis paladium, platinum, atau nikel, Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbon-karbon.
Cara yang mudah untuk melihat proses redoks adalah, reduktor mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam sebuah reaksi disebut sebagai pasangan redoks.
Contoh reaksi redoks
Salah satu contoh reaksi redoks adalah antara hidrogen dan fluorin:Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
Reaksi penggantian
Redoks terjadi pada reaksi penggantian tunggal atau reaksi substitusi.Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:
Contoh-contoh lainnya
- Besi(II) teroksidasi menjadi besi(III)
- hidrogen peroksida tereduksi menjadi hidroksida dengan keberadaan sebuah asam:
- H2O2 + 2 e− → 2 OH−
- 2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
- denitrifikasi, nitrat tereduksi menjadi nitrogen dengan keberadaan asam:
- 2NO3− + 10e− + 12 H+ → N2 + 6H2O
- Besi akan teroksidasi menjadi besi(III) oksida dan oksigen akan tereduksi membentuk besi(III) oksida (umumnya dikenal sebagai perkaratan):
- 4Fe + 3O2 → 2 Fe2O3
- Pembakaran hidrokarbon, contohnya pada mesin pembakaran dalam, menghasilkan air, karbon dioksida, sebagian kecil karbon monoksida, dan energi panas. Oksidasi penuh bahan-bahan yang mengandung karbon akan menghasilkan karbon dioksida.
- Dalam kimia organik, oksidasi seselangkah (stepwise oxidation) hidrokarbon menghasilkan air, dan berturut-turut alkohol, aldehida atau keton, asam karboksilat, dan kemudian peroksida.
Reaksi redoks dalam industri
Proses utama pereduksi bijih logam untuk menghasilkan logam didiskusikan dalam artikel peleburan.Oksidasi digunakan dalam berbagai industri seperti pada produksi produk-produk pembersih.
Reaksi redoks juga merupakan dasar dari sel elektrokimia.
Senin, 03 Desember 2012
PERPAMSI Dorong Investasi di Bidang Air Minum

Sebagai pimpinan satu pihak yang akan ikut menyukseskan acara tersebut, Presiden Direktur PT Infrastructure Asia, Alan Solow, ketika melakukan kunjungan ke PERPAMSI pada 5 Oktober lalu menjelaskan, digelarnya seminar ini sebagai bentuk kerja sama perusahaannya dengan PERPAMSI. Tujuannya, tak lain untuk mengembangkan pengelolaan air minum dan air limbah di Indonesia.
“Setelah pertemuan itu, kami harapkan akan banyak investor yang menanamkan modalnya untuk proyek-proyek air minum dan pengelolaan limbah di Indonesia,” ujar Alan, yang didampingi Conference Manager PT Infrastructure Asia, Vidia Anugrah. Selain itu, ia berharap, dari seminar tersebut perusahaannya dapat memberikan berbagai informasi terbaru mengenai kebijakan yang dibuat Pemerintah Pusat kepada pemerintah provinsi. Informasi lain yang akan diberikan yakni dalam hal teknologi terbaru yang berkaitan dengan water and waste management.
Direktur Eksekutif PERPAMSI, Ir. H. Agus Sunara, menambahkan, seminar tersebut akan berlangsung pada 26 dan 27 November di Hotel Ritz-Carlton, Jakarta. Dari seminar ini diharapkan ada ketertarikan investor untuk meningkatkan investasi bidang air minum dan limbah ke beberapa daerah. Dalam kesempatan tersebut juga akan diundang para bupati dan wali kota yang memiliki potensi untuk berinvestasi di dua bidang tersebut.
“Tugas kita selaku PERPAMSI yang memiliki banyak anggota, tentu bagaimana memberikan informasi tentang kesempatan penanaman modal kepada calon investor. Tujuannya, meningkatnya investasi di sektor air minum untuk pencapaian MDG,” tandasnya.
Dengan adanya peningkatan investasi, Agus meyakini, cakupan pelayanan juga bisa ditingkatkan, yang pada akhirnya memberikan kesejahteraan bagi masyarakat. Dalam kegiatan ini PERPAMSI juga akan meminta para anggota PERPAMSI, yakni setiap PDAM, untuk menyiapkan diri bila nanti diperlukan informasi detail mengenai investasi apa yang dibutuhkan dan berapa besaran investasi yang diharapkan. “Syukur-syukur PDAM sudah memiliki proposal bisnisnya untuk bekerja sama dengan pihak ketiga. Saya kira itu poin pentingnya, buka wawasan, terutama untuk akses permodalan,” ucapnya lagi. Hendra Jamal
2025, Air Bersih di Seluruh Indonesia Terpenuhi

Djoko Kirmanto (dok Okezone)
Djoko Kirmanto di sela-sela acara perayaan Hari Air Sedunia 'Water for Cities: Responding to the Urban Challenge' di Jakarta, sempat menyatakan beberapa sasaran dari Departemen Pekerjaan Umum dan pemerintah untuk isu air bersih dan pengelolaan tata ruang kota.
"Tahun 2025 pemerintah menargetkan kebutuhan air bersih akan merata di seluruh Indonesia," ungkap Djoko Kirmanto di Jakarta, Selasa (22/3/2011).
Djoko Kirmanto menyatakan kalau saat ini hanya 50 persen masyarakat di Indonesia yang terpenuhi kebutuhan akan air bersih.
"Pemerintah juga menargetkan kalau tahun 2015 angka tersebut akan meningkat hingga mencapai 68 persen," ungkap Djoko Kirmanto.
Pengelolaan air perkotaan yang kurang baik di Indonesia banyak dikatakan penyebabnya adalah penggunaan tata ruang kota yang masih semerawut.
"Kami dari Departemen Pekerjaan Umum tahun ini berencana akan memperbaiki semua tata ruang kota untuk tingkat provinsi. Lalu tahun 2012, kami berencana akan memperbaiki semua tata ruang kota untuk tingkat kabupaten," jelas Djoko.
Ketika ditanya tanggapannya mengenai Hari Air Sedunia hari ini, khususnya penerapannya untuk Indonesia, Djoko menjawab kalau kita terlebih dahulu harus merubah perilaku masyarakat terhadap alam di sekitarnya.
Senin, 20 Juli 2009
Penawaran
CV TRI TUNGGAL PERKASA PRIMA Spesialis water treatment :
Adalah perusahaan yang bergerak dibidang water treatment system.
Kami bisa menyelesaikan masalah air anda tanpa membuat masalah baru.
System dan teknologi kami tidak membutuhkan biaya tambahan yang keluar setiap hari.
System dan teknologi kami tidak membutuhkan kougulan untuk menetralkan air bermasalah.
Kami khusus menangani air bermasalah dengan debit minimal 10 ltr/dtk.
Spesialis kami ada pada air dengan kandungan Fe, Mn diatas 3 ppm
Bila anda berminat cukup kami diberi :
- Hasil analisa akhir air anda
- Debit dan asal air
- Ukuran lahan
- Skema asal air
Silakan kirim ke email : tri.tpp@gmail.com
Pastikan masalah air anda terselesaikan tanpa masalah.
Langganan:
Postingan (Atom)